Содержание
2. Порядок государственной регистрации производства и оборота спирта и алкогольной продукции \ КонсультантПлюс
2. Порядок государственной регистрации производства
и оборота спирта и алкогольной продукции
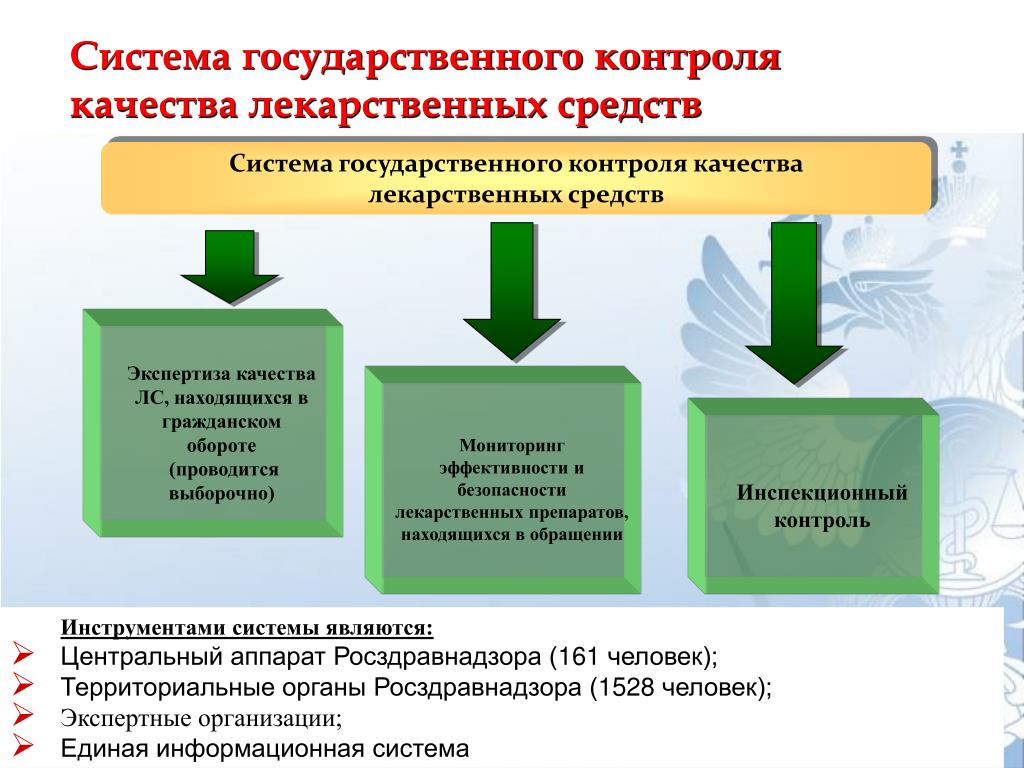
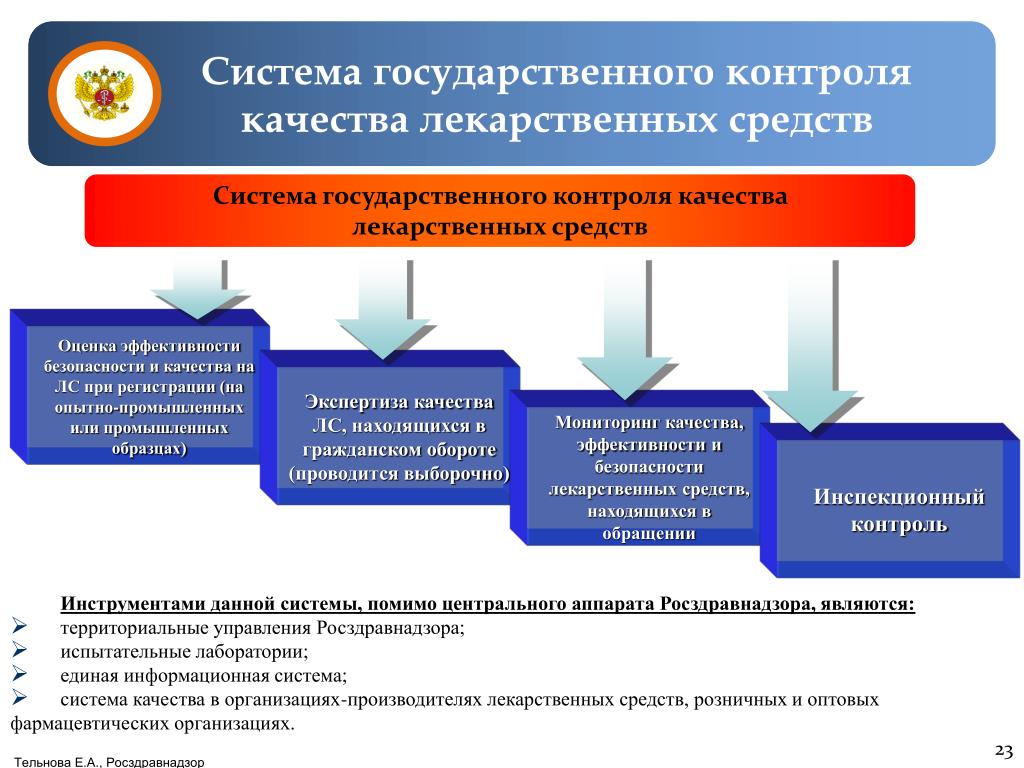
2.1. Государственная регистрация производства и оборота спирта и алкогольной продукции предусматривает проведение экспертной оценки нормативных и технических документов, идентификацию готовой продукции установленным характеристикам и ведение реестра. Результатом экспертной оценки продукции является подтверждение соответствия:
медико — биологическим нормам;
органолептических и физико — химических показателей качества готовой продукции требованиям, предусмотренным документацией;
упаковки и маркировки продукции требованиям Закона Российской Федерации «О защите прав потребителей» и нормативных документов;
кодам ОКП и ТН ВЭД;
наименования заявленной продукции, места происхождения.
Государственная регистрация включает следующие стадии:
подача и рассмотрение заявки на регистрацию;
экспертиза нормативной документации на продукцию;
испытание качества продукции;
рассмотрение результатов экспертизы и испытаний качества продукции;
принятие решения;
государственная регистрация.
2.2. Заявитель обращается в Минсельхозпрод России (107139, Москва, Б-139, Орликов пер., 1/11) с заявкой о регистрации продукции (прилагается).
2.3. К заявке прилагаются в 3 экземплярах (подлинник и 2 копии):
нормативная и техническая документация (ОСТ, ТУ, ТИ, РЦ) на продукцию;
КонсультантПлюс: примечание.
Федеральная служба России по обеспечению государственной монополии на алкогольную продукцию упразднена Указом Президента РФ от 10.01.1998 N 14. Лицензирование деятельности в области производства и оборота этилового спирта, алкогольной и спиртосодержащей продукции осуществляет Федеральная служба по регулированию алкогольного рынка (Постановление Правительства РФ от 24.02.2009 N 154).
уведомление о лицензии, выданной в установленном порядке Федеральной службой России по обеспечению государственной монополии на алкогольную продукцию с указанием ее номера;
гигиеническое заключение (сертификат), выданное органами Госсанэпиднадзора.
Подлинники документов после государственной регистрации возвращаются Заявителю, одна копия остается в государственном реестре, вторая копия передается Федеральной службе России по обеспечению государственной монополии на алкогольную продукцию.
2.4. Минсельхозпрод России заключает договор с Заявителем на проведение регистрации продукта и выдачу регистрационного удостоверения.
2.5. Заявка регистрируется в журнале ответственным лицом Минсельхозпрода России по мере поступления.
2.6. Подлинники заявки и сопроводительной документации остаются у ответственного лица Минсельхозпрода России, а копии зарегистрированной заявки и документации с образцами продукции Заявитель передает в соответствующий научно — исследовательский институт по закрепленной группе продукции.
2.7. Образцы представляются в количестве, предусмотренном действующими стандартами на отбор проб данной продукции. Вместо образцов продукции для оценки физико — химических показателей допускается представлять протоколы испытаний этих образцов, проведенных в лабораториях, аккредитованных органами Госстандарта России на техническую компетентность и независимость.
2.8. Оценка органолептических показателей осуществляется Центральными дегустационными комиссиями Минсельхозпрода России по закрепленной номенклатуре.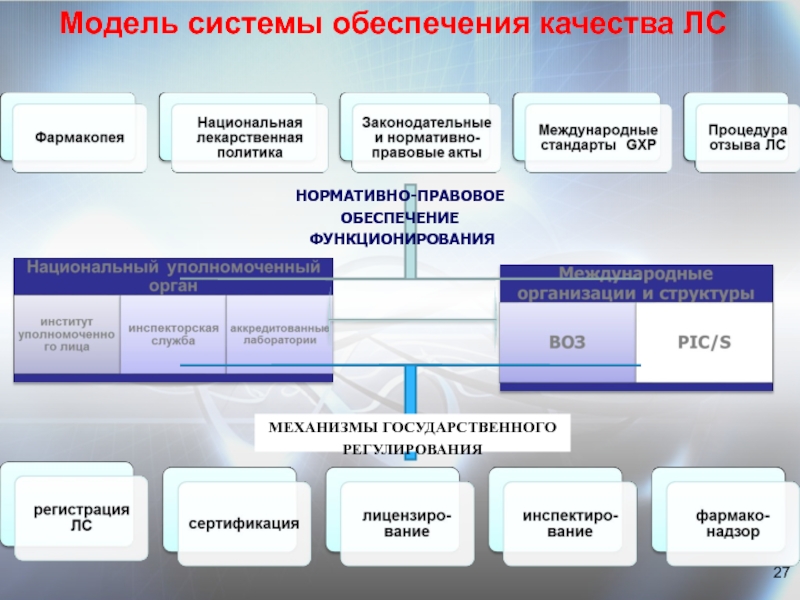
2.9. Качество импортируемой алкогольной продукции должно быть не ниже требований, предусмотренных государственными и отраслевыми стандартами и техническими условиями на аналогичную продукцию, выпускаемую в Российской Федерации, а на принципиально отличную — требованиям Министерства здравоохранения Российской Федерации в части ее безопасности.
2.10. На основании заключений экспертизы, протоколов Центральных дегустационных комиссий и документов, указанных в пункте 2.3, ответственное лицо Минсельхозпрода России вносит продукцию в государственный реестр и выдает регистрационное удостоверение или отказывает в регистрации с указанием причин отказа.
2.11. Срок действия регистрационного удостоверения 5 лет, за исключением случаев выдачи удостоверения на ограниченный период до пересмотра нормативной документации.
2.12. Не менее чем за 2 месяца до истечения срока действия регистрационного удостоверения Заявитель должен представить заявление на перерегистрацию продукта в порядке, установленном настоящим Положением.
2.13. Держатель подлинника регистрационного удостоверения информирует Минсельхозпрод России при изменении состава продукции, технологии производства или при появлении достоверных данных о проявлении побочных действий при применении продукта, которые не были известны на момент регистрации. В этом случае Минсельхозпрод России принимает решение о прекращении действия регистрационного удостоверения, о чем информирует Государственный комитет Российской Федерации по стандартизации, метрологии и сертификации, Федеральную службу России по обеспечению государственной монополии на алкогольную продукцию, Федеральную налоговую службу России и Министерство внешних экономических связей Российской Федерации.
Статья 31. Государственная регистрация производственных объектов \ КонсультантПлюс
Статья 31. Государственная регистрация производственных объектов
1. Участник хозяйственной деятельности имеет право осуществлять процессы производства (изготовления) пищевой продукции, указанные в статье 32 настоящего технического регламента, на таможенной территории Таможенного союза только после государственной регистрации производственных объектов, на которых осуществляются данные процессы производства (изготовления).
2. Государственная регистрация производственных объектов осуществляется уполномоченным государством — членом Таможенного союза органом (далее — орган по регистрации производственных объектов) на основании заявления о государственной регистрации производственного объекта, направляемого участником хозяйственной деятельности (далее — заявитель).
3. Заявитель направляет заявление о государственной регистрации производственного объекта в орган по регистрации производственных объектов по месту планируемого начала осуществления процессов производства (изготовления) пищевой продукции, указанных в статье 32 настоящего технического регламента.
4. Заявление на бумажном носителе должно быть подписано уполномоченным представителем участника хозяйственной деятельности, а также соответствовать требованиям статьи 33 настоящего технического регламента.
5. Заявление о государственной регистрации производственного объекта и прилагаемые к нему документы может быть направлено почтовым отправлением с описью вложения и уведомлением о вручении или в электронной форме.
6. Прилагаемые копии документов на бумажном носителе должны быть заверены заявителем. Ответственность за достоверность сведений, содержащихся в прилагаемых документах, несет заявитель.
7. В течение не более 30 дней с момента поступления заявления о государственной регистрации производственного объекта орган по регистрации производственных объектов обязан провести проверку соответствия регистрируемых производственных объектов требованиям к процессу производства, установленным в настоящем техническом регламенте и (или) технических регламентах Таможенного союза на отдельные виды пищевой продукции. Проверка осуществляется в порядке, предусмотренном законодательством государства — члена Таможенного союза.
8. По результатам проверки регистрируемого производственного объекта орган по регистрации производственных объектов принимает решение о государственной регистрации производственного объекта, присваивает ему идентификационный (учетный) номер и вносит производственный объект в реестр производственных объектов по производству пищевой продукции, подлежащих государственной регистрации, либо выдает предписание об устранении выявленных нарушений.
9. После устранения нарушений, указанных в предписании, заявитель письменно уведомляет орган по регистрации производственных объектов о выполнении предписания и устранении выявленных нарушений. Уведомление об устранении выявленных нарушений должно содержать сведения о факте и способах устранения выявленных нарушений, мерах по профилактике выявленных нарушений. Уведомление направляется в порядке, установленном в части 3, 5 настоящей статьи.
10. Орган по регистрации производственных объектов имеет право осуществить проверку выполнения предписания в порядке, установленном частью 7 настоящей статьи, в течение 15 рабочих дней с момента получения уведомления о выполнении предписания и устранения всех выявленных нарушений и принять решение о государственной регистрации производственного объекта либо решение об отказе в государственной регистрации производственного объекта.
11. Государственная регистрация производственного объекта является бессрочной.
12. Основанием для отказа в государственной регистрации производственного объекта является невыполнение предписания об устранении выявленных нарушений требований настоящего технического регламента и требований иных технических регламентов Таможенного союза, действие которых на нее распространяется. Отказ в государственной регистрации производственного объекта должен быть выполнен в письменной форме и содержать указание на требования технического регламента, которые были нарушены. Отказ в государственной регистрации производственного объекта должен быть вручен представителю заявителя лично либо отправлен заявителю почтовым отправлением с уведомлением о вручении.
Отказ в государственной регистрации производственного объекта должен быть выполнен в письменной форме и содержать указание на требования технического регламента, которые были нарушены. Отказ в государственной регистрации производственного объекта должен быть вручен представителю заявителя лично либо отправлен заявителю почтовым отправлением с уведомлением о вручении.
13. Государственная регистрация производственного объекта может быть прекращена органом по регистрации производственных объектов в случае установления факта несоответствия процесса производства требованиям настоящего технического регламента в результате проведенного государственного контроля (надзора), по решению судебных органов государства — члена Таможенного союза.
14. Заявитель имеет право обжаловать решение органа по регистрации производственных объектов в судебном порядке.
Регистрация для производства — Управление цепочками поставок | Динамика 365
Редактировать
Твиттер
Фейсбук
Электронная почта
- Статья
В этой статье описываются основные понятия и термины, которые необходимо понимать для настройки и использования производственного исполнения.
Производственное исполнение предназначено в первую очередь для производственных компаний. Рабочие могут регистрировать время и потребление предметов на производственных заданиях, используя Регистрация работы стр. Все регистрации утверждаются и позже переносятся в соответствующие модули. Непрерывное утверждение и передача регистраций позволяет менеджерам легко отслеживать фактические затраты по производственным заказам.
Терминология производственного исполнения и регистрации
В следующей таблице приведены термины, относящиеся к производственному исполнению и связанным с ним задачам регистрации.
| Срок | Описание |
|---|---|
| Производственное исполнение | Функция, которая используется для регистрации времени, потребления материалов, затрат на производственные задания, проекты и косвенные действия. Регистрация производится в клиенте регистрации производственного исполнения. Регистрация производится в клиенте регистрации производственного исполнения. |
| Список заданий | На странице Регистрация задания работникам отображается список заданий, которые они должны выполнять на определенном ресурсе, например на машине. Работник может зарегистрировать потребление времени и предметов для каждого задания или задачи в списке заданий. |
| Объединение вакансий | Если работник одновременно запускает несколько заданий на странице Регистрация задания , это называется объединением заданий. Время, затраченное на объединенные задания, может распределяться между отдельными заданиями различными способами с помощью ключей распределения. |
| Регистрация пилотов/помощников | Рабочий может зарегистрироваться в качестве помощника ресурса и может создать небольшую команду, в которой несколько рабочих работают над одними и теми же производственными заданиями. Ресурсы, к которым работники подключаются в качестве помощников, называются пилотными. Регистрации должен делать только пилотный ресурс. Все помощники автоматически получают одинаковые регистрации. Например, если машина выступает в качестве пилота, работники, зарегистрированные в качестве помощников этой машины, могут регистрироваться на 9-й странице.0019 Регистрация работы , и машина, и рабочие, подключенные в качестве помощников, получат одинаковые регистрации. Регистрации должен делать только пилотный ресурс. Все помощники автоматически получают одинаковые регистрации. Например, если машина выступает в качестве пилота, работники, зарегистрированные в качестве помощников этой машины, могут регистрироваться на 9-й странице.0019 Регистрация работы , и машина, и рабочие, подключенные в качестве помощников, получат одинаковые регистрации. |
| Косвенная деятельность | Действие или задача, не связанные напрямую с производственным заданием или проектом, например собрание отдела, работа по уборке или работа по техническому обслуживанию в цехе. Работники могут регистрироваться в отношении непрямой деятельности точно так же, как они могут регистрироваться в отношении производственных заданий и проектов. |
Регистрации в производственном исполнении
Рабочие могут выполнять различные типы регистраций в производственном исполнении для работы, выполняемой на производственных заданиях.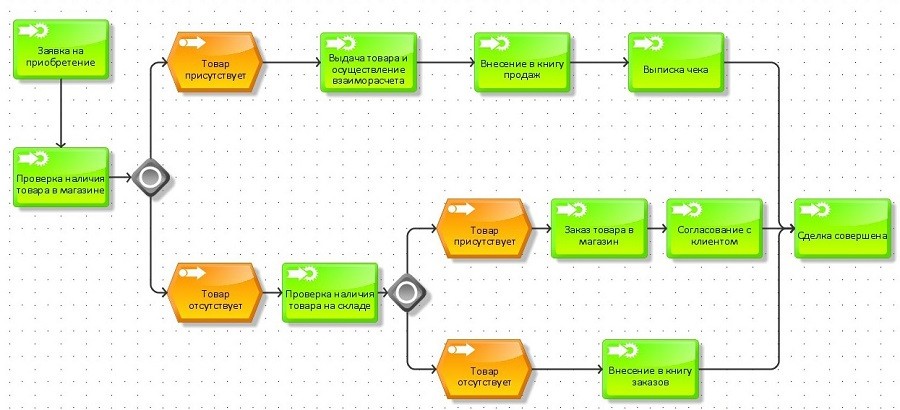 В зависимости от настройки системы работники могут также иметь возможность регистрировать деятельность проекта и непродуктивные задачи, такие как перерывы, отсутствия и непрямые действия. Вот типы регистрации:
В зависимости от настройки системы работники могут также иметь возможность регистрировать деятельность проекта и непродуктивные задачи, такие как перерывы, отсутствия и непрямые действия. Вот типы регистрации:
- Время прихода/ухода (доступно со временем и посещаемостью) — Рабочие приходят на работу, когда приходят на работу, и уходят, когда идут домой.
- Регистрация производственных заданий — Работники могут выполнять регистрацию, например начинать задание и сообщать отзывы о задании, для производственных заданий, которые отображаются в их списке заданий. Рабочие могут начинать несколько работ одновременно. Это называется объединением вакансий.
- Регистрация в инвентаре . Рабочие могут регистрировать материалы, которые используются в цехе, но не связаны напрямую с производственными заданиями. Примеры включают консистентную смазку, смазочные материалы или другие материалы, которые используются для поддержания работы машин.
 Регистрация производится в журнале инвентаризации.
Регистрация производится в журнале инвентаризации. - Зарегистрируйтесь в проектах (доступно с учетом времени и посещаемости) — работники могут регистрироваться, например, начинать и заканчивать работу над проектами или действиями проекта, которые указаны в их списке заданий.
- Регистрация сборов за проект и элементов проекта (доступно с учетом времени и посещаемости) — работники могут регистрировать сборы (расходы), связанные с проектом, в журнале сборов за проект, например, пробег и плату за проезд по мосту. Рабочие также могут регистрировать потребление предметов в проектах. Это делается в журнале элементов проекта.
- Зарегистрируйтесь в качестве помощника другого работника — Если два или более рабочих будут работать вместе над производственным заданием или проектом, рабочий может зарегистрироваться в качестве помощника машины или другого рабочего, который затем будет действовать как пилот. При необходимости пилот может выбрать другого работника в качестве пилота.

- Регистрация отсутствия (доступно со временем и посещаемостью) — работники могут регистрировать время с помощью различных настроенных кодов отсутствия. Отсутствие может быть указано, если работник опаздывает, требует отсутствия в течение рабочего дня или уходит раньше, чем положено согласно стандартному профилю рабочего времени.
- Регистрация перерывов (доступно с учетом времени и посещаемости) — в течение рабочего дня работники могут зарегистрировать, что они покидают свое рабочее место, чтобы сделать перерыв. Можно настроить несколько типов перерывов. Когда рабочий возвращается и снова входит в систему, система регистрирует, что рабочий вернулся, и регистрация перерыва прекращается.
- Зарегистрируйте непрямую деятельность (доступно со временем и посещаемостью) — Косвенная деятельность — это непроизводительная деятельность, которой работники могут заниматься в течение рабочего дня, например собрание отдела, собрание команды или работа по техническому обслуживанию, выполняемая в цеху.
 Рабочие могут делать регистрации для косвенных действий, которые настроены.
Рабочие могут делать регистрации для косвенных действий, которые настроены. - Регистрация сверхурочной работы (доступно со временем и посещаемостью) — Работники, которых попросили работать дольше, могут выбрать, следует ли регистрировать дополнительные часы как гибкий график или как сверхурочную работу.
Обратная связь
Просмотреть все отзывы о странице
Регистрация и листинг | FDA
Как зарегистрировать объекты и продукты и как обновить регистрацию
Животноводство и ветеринария
Отечественные и иностранные предприятия, которые производят, переупаковывают или перемаркируют лекарственные препараты для животных в США, должны зарегистрироваться в FDA. Отечественные и иностранные производители лекарств, переупаковщики или перемаркировщики также обязаны перечислять все свои коммерческие лекарственные препараты. Этот процесс осуществляется в сочетании с процессом регистрации лекарств для человека.
- Руководство для промышленности – Предоставление нормативных документов в электронном формате – Регистрация фармацевтических учреждений и перечень лекарственных средств
- Руководство по политике и процедурам 1240.3560 – Регистрация производителей лекарств и включение лекарств в коммерческое распространение
- Пошаговые инструкции по созданию файлов SPL для электронных лекарственных препаратов
- Маркировка структурированных продуктов
Косметика
FDA прекратило прием и обработку как электронных, так и бумажных документов для программы добровольной регистрации косметических предприятий и продуктов 27 марта 2023 года. Мы разрабатываем программу подачи регистраций предприятий и списков продуктов, предусмотренных Законом о модернизации косметических средств от 2022 года (MoCRA), и будем предоставлять дальнейшие обновления о ее предстоящей доступности. Для получения дополнительной информации посетите: Закон о модернизации косметических средств от 2022 г.
Лекарства
Отечественные и иностранные предприятия, которые производят, переупаковывают или перемаркируют лекарственные препараты в США, должны зарегистрироваться в FDA. Отечественные и иностранные производители лекарств, переупаковщики или перемаркировщики также обязаны перечислять все свои коммерческие лекарственные препараты. Эта информация помогает FDA вести каталог всех лекарств, находящихся в коммерческом распространении в Соединенных Штатах.
- Система регистрации и перечня лекарственных средств
- Лекарственные учреждения Текущий сайт регистрации
Пищевые продукты
Владельцы, операторы или агенты, отвечающие за отечественные или зарубежные предприятия, производящие/перерабатывающие, упаковывающие или хранящие пищевые продукты для потребления в США, должны зарегистрировать предприятие в FDA.
- Регистрация предприятий общественного питания
Медицинские устройства
Владельцы или операторы предприятий (также называемых учреждениями или объектами), которые занимаются производством и распространением медицинских устройств, предназначенных для использования в Соединенных Штатах (США), обязаны ежегодно регистрироваться в FDA. Этот процесс известен как регистрация заведения.
Этот процесс известен как регистрация заведения.
- Регистрация и список устройств
Продукты, излучающие радиацию
Подача отчетов о радиационной безопасности (продукт) для продуктов, испускающих излучение, требуется по закону. Программное обеспечение FDA eSubmitter копирует несколько руководств и форм отчетности. Электронные шаблоны, доступные в настоящее время в eSubmitter, представляют собой большинство форм, которые индустрия должна подавать в FDA.
- eSubmitter: Программа радиологического здоровья
Табачные изделия
В соответствии со статьей 905 Закона о борьбе против табака каждое лицо, которое владеет или управляет какими-либо домашними предприятиями, занимающимися производством, подготовкой, смешиванием или переработкой регулируемых табачных изделий, должно зарегистрировать эти предприятия в FDA до 31 декабря каждого года. Все зарегистрированные лица также должны представить список всех табачных изделий, которые производятся этим лицом для коммерческого распространения, вместе с определенной сопроводительной информацией, включая всю маркировку.
- Руководство для промышленности: регистрация и перечень продукции для владельцев и операторов предприятий по производству отечественных табачных изделий
FDA настоятельно рекомендует подавать документы в электронном виде. Для подачи такой информации в электронном виде FDA использует Модуль регистрации табачных изделий и списка продуктов — следующее поколение (TRLM NG).
- Доступ к модулю регистрации табачных изделий и перечня продуктов – новое поколение (TRLM NG)
В качестве альтернативы вы можете использовать форму FDA 3741 для регистрации предприятия и списка продуктов. Лица с ограниченными возможностями, у которых есть проблемы с доступом к указанному выше файлу в формате PDF, могут позвонить по телефону 1-877-CTP-1373 для получения помощи.
Вакцины, кровь, биопрепараты
Если вы являетесь предприятием, производящим человеческие клетки, ткани и продукты на основе клеток и тканей (HCT/Ps), правила FDA требуют, чтобы вы зарегистрировались в агентстве и перечислили ваши HCT/Ps. «Производство» включает любые или все этапы, связанные с извлечением, обработкой, хранением, маркировкой, упаковкой или распространением HCT/Ps, а также скрининг или тестирование донорских клеток или тканей. См. ниже информацию о том, как зарегистрироваться в FDA:
«Производство» включает любые или все этапы, связанные с извлечением, обработкой, хранением, маркировкой, упаковкой или распространением HCT/Ps, а также скрининг или тестирование донорских клеток или тканей. См. ниже информацию о том, как зарегистрироваться в FDA:
- Регистрация учреждения тканей
- Приложение для регистрации человеческих клеток и тканей (HCTERS)
Правила FDA требуют регистрации всех учреждений крови, которые собирают, производят, подготавливают, хранят в контролируемых условиях для дальнейшего распространения или перерабатывают кровь и продукты крови. Подробную информацию о регистрации учреждения службы крови см. ниже:
- Инструкции по заполнению формы электронной регистрации учреждения службы крови (BER) и формы списка продуктов
- Регистрация учреждения службы крови и перечень продуктов
Отечественные и зарубежные предприятия, которые производят, переупаковывают или перемаркируют лекарственные и биологические продукты, включая вакцины, должны зарегистрироваться в FDA.

 Регистрация производится в журнале инвентаризации.
Регистрация производится в журнале инвентаризации.
 Рабочие могут делать регистрации для косвенных действий, которые настроены.
Рабочие могут делать регистрации для косвенных действий, которые настроены.